
Кислоти і основи – Що таке кислоти і основи?
Кислоти та основи є популярними хімічними речовинами, які взаємодіють одна з одною, що призводить до утворення солі та води. Слово кислота походить від латинського слова «acere» , що означає «кислий» .
У повсякденному житті ми використовуємо багато сполук, які вчені називають кислотами. Апельсиновий або грейпфрутовий сік, який ви п’єте на сніданок, містить лимонну кислоту (також відому як вітамін С). Коли молоко скисає, воно містить молочну кислоту. Оцет, який використовується для заправки салатів, містить оцтову кислоту. Відповідно до цього хімічний зв’язок вважається таким, що складається з кислотно-основної комбінації. Таким чином, властивості молекули можна зрозуміти, розділивши її на кислотний і основний фрагменти.
Визначення кислот і основ
Кислота – це будь-яка водневмісна речовина, яка здатна віддавати протон (іон водню) іншій речовині. Основа – це молекула або іон, здатний приймати іон водню від кислоти.
Кислі речовини зазвичай визначають за кислим смаком. Кислота — це в основному молекула, яка може віддавати іон Н + і може залишатися енергетично сприятливою після втрати Н + . Відомо, що кислоти забарвлюють синій лакмус у червоний.
Основи, навпаки, характеризуються гірким смаком і слизькою текстурою. Основу, яку можна розчинити у воді, називають лугом. Коли ці речовини вступають у хімічну реакцію з кислотами, вони дають солі. Відомо, що основи забарвлюють червоний лакмус у синій колір.
Хімія визначення кислот
Терміни «кислота» та «основа» визначаються по-різному, залежно від конкретного погляду на властивості кислотності та основності. Арреніус вперше визначив кислоти як сполуки, які іонізуються з утворенням іонів водню, а основи — як сполуки, які іонізуються з утворенням гідроксид-іонів. Згідно з визначенням Лоурі-Бронстеда, кислота є донором протона, а основа – акцептором протона.
Згідно з визначенням Льюїса, кислоти – це молекули або іони, здатні координуватися з неподіленими електронними парами, а основи – це молекули або іони, які мають неподілені електронні пари, доступні для спільного використання з кислотами. Щоб бути кислотною в сенсі Льюїса, молекула повинна мати дефіцит електронів. Це найзагальніша кислотно-основна концепція. Усі кислоти Лоуері-Бронстеда є кислотами Льюїса, але, крім того, визначення Льюїса включає багато інших реагентів, таких як трифторид бору, хлорид алюмінію тощо.
Теорії кислот і основ
Для визначення кислот і основ було висунуто три різні теорії. Ці теорії включають теорію Арреніуса, теорію Бренстеда-Лоурі та теорію кислот і основ Льюїса. Короткий опис кожної з цих теорій подано в цьому підрозділі. Кислоти та основи можна визначити за допомогою трьох різних теорій.
- Теорія кислот і основ Арреніуса стверджує, що «кислота генерує іони H + у розчині, тоді як основа виробляє іони OH – у своєму розчині».
- Теорія Бренстеда -Лоурі визначає «кислоту як донор протона, а основу — як акцептор протона».
- Нарешті, визначення кислот і основ Льюїса описує «кислоти як акцептори електронних пар, а основи як донори електронних пар».
pH кислот і основ
Щоб знайти числове значення рівня кислотності або основності речовини, можна використовувати шкалу pH (де pH означає «потенціал водню»). Шкала рН є найпоширенішим і надійним способом вимірювання кислотності або основності речовини. Показник за шкалою рН може варіюватися від 0 до 14 , де 0 означає найкислішу речовину, а 14 — найосновнішу.
Інший спосіб перевірити, кислотна чи основна речовина, — скористатися лакмусовим папірцем. Існує два типи лакмусового паперу, який можна використовувати для визначення кислот і лугів – червоний лакмусовий папірець і синій лакмусовий папірець. Синій лакмусовий папірець стає червоним у кислих умовах, а червоний лакмусовий папірець стає синім у лужних або лужних умовах.
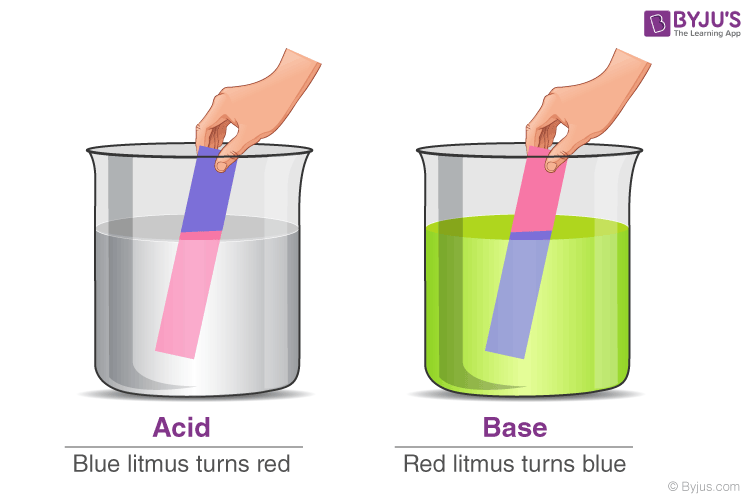
Властивості кислот і основ
1. Властивості кислот
- Кислоти мають корозійну природу.
- Вони є хорошими провідниками електрики.
- Їх значення pH завжди менше 7.
- При взаємодії з металами ці речовини утворюють газоподібний водень.
- Кислоти кислі на смак.
- Приклади: сірчана кислота [H 2 SO 4 ], соляна кислота [HCl], оцтова кислота [CH 3 COOH].
2. Властивості основ
Деякі властивості, як гіркий смак, властиві всім основам. Основи теж слизькі. Сниться, як виглядає слизьке мило. І це фундамент. Крім того, при зануренні у воду основи проводять електрику, оскільки складаються із заряджених частинок у розчині.
- Виявлено, що вони мають мильну текстуру при дотику.
- Ці речовини при розчиненні у воді виділяють гідроксид-іони (OH – іони).
- У своїх водних розчинах основи діють як хороші провідники електрики.
- Значення pH, що відповідають основам, завжди більше 7.
- Основи — це гіркі на смак речовини, які мають здатність забарвлювати червоний лакмусовий папірець у синій колір.
- Приклади: гідроксид натрію [NaOH], магнезіальне молоко, гідроксид кальцію [Ca(OH) 2 ].
3. Нейтральні речовини
Нейтральна речовина – це речовина, яка не є кислотною чи основною, має однакову кількість іонів водню та гідроксилу та не змінює колір поверхні лакмусу.
- Ці речовини не мають кислотних або основних властивостей.
- Їх значення pH наближаються до 7.
- На червоний або синій лакмусовий папірець нейтральні речовини не діють.
- pH чистої води дорівнює рівно 7.
- Приклади: вода, кухонна сіль (NaCl)
Різниця між кислотами та основами
| Кислоти | Бази |
| Кислота виділяє іони водню при розчиненні у воді. | Основи виділяють гідроксильний іон при розчиненні у воді. |
| Він перетворює синій лакмусовий папірець на червоний. | Він перетворює червоний лакмусовий папірець на синій. |
| Має кислий смак. | Він має гіркий смак і мильний на дотик. |
| Його значення pH коливається від 1 до 7. | Його значення pH коливається від 7 до 14. |
| Приклад: HCl, H 2 SO 4 тощо. | Приклад: NaOH, KOH тощо. |
Поняття Арреніуса про кислоти та основи
- Шведський вчений Сванте Август Арреніус визначив кислоти як речовини, які підвищують концентрацію іонів H + у воді, розчиняючись у ній.
- Ці протони продовжують утворювати іони гідроній (H 3 O + ) шляхом поєднання з молекулами води.
- Подібним чином у визначенні основи Арреніусом зазначено, що основи — це речовини, які при розчиненні у воді збільшують у ній концентрацію іонів OH – .
- Одним із достоїнств цієї теорії є те, що вона успішно пояснює реакцію між кислотами та основами, яка дає солі та воду.
- Важливим обмеженням визначень Арреніуса кислот і основ є те, що воно не може пояснити, як речовини без гідроксид-іонів утворюють основні розчини при розчиненні у воді, наприклад NO 2 – і F – .
Теорія кислот і основ Бренстеда Лоурі
- Теорія Бренстеда-Лоурі визначає кислоту як донора протонів.
- За цією теорією основа визначається як акцептор протона (або акцептор іону H + ).
- Кислоти Бренстеда піддаються дисоціації з утворенням протонів і, отже, збільшують концентрацію іонів Н + у розчині.
- З іншого боку, основи Бренстеда приймають протони з води (розчинника) для утворення гідроксид-іонів.
- Перевагою визначення кислот і основ Бренстеда-Лоурі є його здатність пояснити кислотну або основну природу іонних сполук.
- Важливим обмеженням цієї теорії є те, що вона не може пояснити, як сполуки без водню виявляють кислотні властивості, такі як BF 3 і AlCl 3 .
Спряжені кислоти та основи
- Відповідно до концепції Бренстеда-Лоурі, кислота – це речовина, яка може віддавати H+, а основа – речовина, яка може приймати H+.
- Кажуть, що кислота й основа, які відрізняються протоном, утворюють спряжену пару кислоти й основи.
- Спряжена кислота утворюється , коли протон додається до основи, а спряжена основа утворюється, коли протон видаляється з кислоти.
Приклади: Розглянемо таку реакцію,
CH 3 COOH + H 2 O ⇋ CH 3 COO – + H 3 O +
У наведеному вище рівнянні кислота: CH 3 COOH, сполучена основа: CH 3 COO –
Основа: H 2 O, сполучена кислота: H 3 O +
Примітка. Кон’югатна кислота утворюється шляхом додавання іона H+ до основи, кон’югатна основа – шляхом видалення іона H+ із кислоти.
( a) Кон’югатною основою H 2 PO 4 – є H 2 PO 4 – – H+ ⇋ HPO 4 2-
Кон’югат основа H 2 PO 4 – це HPO 4 2-
Поняття Льюїса про кислоти та основи
- Визначення кислоти Льюїсом стверджує, що це вид, який має вакантну орбіталь і, отже, має здатність приймати електронну пару.
- Основа Льюїса — це вид, який утримує неподілену пару електронів і, отже, може діяти як донор електронної пари.
- Ця теорія не включає атом водню у своє визначення кислот і основ.
- Кислоти Льюїса є електрофільними за своєю природою, тоді як основи Льюїса мають нуклеофільні властивості.
- Приклади кислот Льюїса: Cu 2+ , BF 3 і Fe 3+ . Приклади основ Льюїса: F – , NH 3 і C 2 H 4 (етилен).
- Кислота Льюїса приймає електронну пару від основи Льюїса, утворюючи при цьому координатний ковалентний зв’язок. Отриману сполуку називають аддуктом Льюїса.
- Помітною перевагою цієї концепції є те, що за її допомогою багато сполук можна визначити як кислоти або основи. Однак він мало дає розуміння сили цих кислот і основ.
- Одним із недоліків цієї теорії є те, що вона не може пояснити кислотно-основні реакції, які не передбачають утворення координатного ковалентного зв’язку.
Використання кислот і основ
Різні способи використання кислот і лугів перераховані в цьому підрозділі.
1. Застосування кислот
- Оцет, розведений розчин оцтової кислоти, має різноманітні побутові застосування. В основному використовується як харчовий консервант.
- Лимонна кислота є складовою частиною соку лимона і апельсина. Його також можна використовувати для консервування їжі.
- Сірчана кислота широко використовується в акумуляторах. Акумулятори, які використовуються для запуску двигунів автомобілів, зазвичай містять цю кислоту.
- Промислове виробництво вибухових речовин, барвників, фарб і добрив передбачає використання сірчаної та азотної кислот.
- Фосфорна кислота є ключовим інгредієнтом багатьох безалкогольних напоїв.
2. Використання баз
- Виробництво мила та паперу передбачає використання гідроксиду натрію. NaOH також використовується у виробництві віскози.
- Ca(OH) 2 , також відомий як гашене вапно або гідроксид кальцію, використовується для виробництва відбілювача.
- За допомогою гідроксиду кальцію виготовляють сухі суміші для фарбування або декорування.
- Гідроксид магнію, також відомий як магнезіальне молоко, зазвичай використовується як проносний засіб. Він також зменшує будь-яку надлишкову кислотність у шлунку людини, тому використовується як антацид.
- Гідроксид амонію є дуже важливим реагентом, який використовується в лабораторіях.
- Надлишок кислотності ґрунту можна нейтралізувати за допомогою гашеного вапна.
Часті запитання – FAQ
Як ви розрізняєте кислоти та основи?
Щоб визначити, чи є речовина кислотою чи основою, підрахуйте атоми водню в кожній речовині до та після реакції. Якщо кількість зменшилася, цією речовиною є кислота (яка віддає іони водню). Якщо кількість атомів водню збільшилася, ця речовина є основою (приймає іони водню)
Що робить щось кислотою або основою?
Кислота – це продукт, що містить іони водню. Якщо розчин містить більше іонів гідроній (H3O+), ніж іонів гідроксилу (OH-), то даний розчин є кислотою. Подібним чином, якщо розчин містить більше гідроксильних іонів (OH-), ніж іонів водню (H+), то даний розчин є основою.
Що таке основа і приклад?
Прикладами основ є гідроксид натрію, карбонат кальцію та оксид калію. Основа – це матеріал, який взаємодіє з іонами водню і може нейтралізувати кислоту. Основи класифікуються як акцептори протона (Н+), а гідроксид амонію є типовим прикладом основ.
Що таке кислота та її властивості?
Кислоти — це іонні сполуки, які при розчиненні у воді утворюють позитивні іони водню (Н+). У розчиненому вигляді кислоти мають кислий смак, проводять електрику та реагують з металами, утворюючи газоподібний водень. Певні сполуки-індикатори можна використовувати для виявлення кислот, наприклад лакмус. Кислоти забарвлюють синій лакмус в червоний колір.
У чому головна відмінність кислоти від основи?
Двома типами корозійних сполук є кислоти та основи. Відомо, що будь-який матеріал зі значенням pH від 0 до 7 є кислим, тоді як значення pH від 7 до 14 є основою. тоді як основи – це іонні сполуки, які утворюють гідроксид-іони (OH-) при розчиненні у воді.
Яке значення кислоти?
Кислоти відіграють важливу роль в організмі людини. Наявність соляної кислоти в шлунку сприяє травленню, розщеплюючи великі і складні молекули їжі. Амінокислоти необхідні для синтезу білка, який допомагає рости та відновлювати тканини організму.
Що таке основа і приклад?
Прикладами основ є гідроксид натрію, карбонат кальцію та оксид калію. Основа – це речовина, яка реагує з іонами водню і може нейтралізувати кислоту. Більшість основ є мінералами, які утворюють воду та солі, реагуючи з кислотами. Основи включають оксиди, гідроксиди та карбонати металів.
Як визначити базу?
Щоб визначити, чи є речовина кислотою чи основою, підрахуйте атоми водню в кожній речовині до та після реакції. Якщо кількість зменшилася, цією речовиною є кислота (яка віддає іони водню). Якщо кількість атомів водню збільшилася, ця речовина є основою (приймає іони водню).
Які фізичні властивості основи?
Базовий гіркий смак має мильну текстуру та виділяє іони гідроксиду при розчиненні у воді. Вони є хорошими провідниками електрики та мають значення pH більше семи. Гідроксид натрію, гідроксид калію та гідроксид магнію є деякими прикладами основ.
Чи може кислота реагувати з металами?
Так, кислоти реагують з металом, утворюючи відповідну сіль і вивільняючи водень.
2 M + 2 HX → 2 MX + H 2
Таким чином, визначення, загальні властивості та використання кислот і основ коротко обговорюються в цій статті.

