
Вода – Яка щільність води?
У побуті вода використовується для санітарно-побутових потреб. Вона також є теплопередавачем і може приймати його, зберігати та віддавати назад.

Щільність і в’язкість води – властивості води, важливі при вивченні питань, пов’язаних з течією в теплопроточних установках і пристроях. Вони є одними з даних, необхідних для розрахунків механіки рідини, і використовуються в основному проектувальниками теплових установок і пристроїв для кількісного опису явищ течії, що відбуваються в пристроях і установках.
Щільність води
Щільність — це відношення маси до об’єму, який займає дана маса.
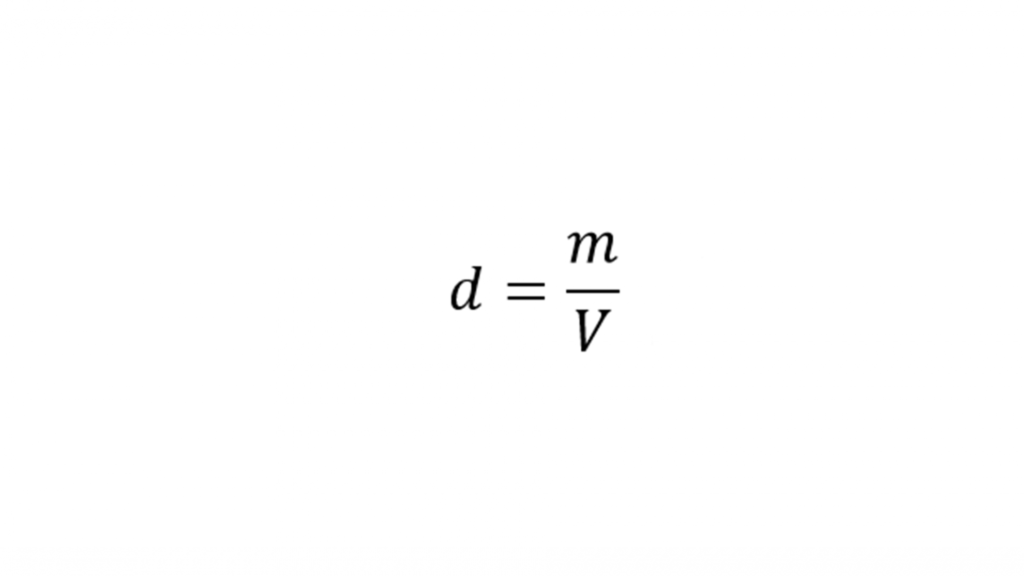
Де:
- m – маса [кг]
- V – об’єм [м] 3
Щільність зазвичай позначають латинською буквою d або грецькою буквою ρ (rho). У міжнародній системі одиниць СІ одиницею щільності є [кг/м3], але вона також може бути виражена в [кг/л] або [г/м3 ] .
У випадку з водою щільність непостійна і залежить від температури і тиску.
За нормального атмосферного тиску щільність води для даної температури можна визначити за формулою 1 , наведеною нижче.
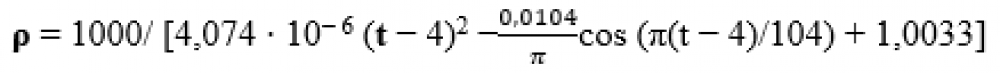
Де:
– t температура [K]
Загалом щільність рідини зменшується з підвищенням температури, але вода в цьому випадку поводиться аномально і досягає найвищої щільності при 4 градусах Цельсія.
Щільність води залежить від температури
Нижче наведена таблиця, що показує щільність води для конкретних значень температури при нормальному атмосферному тиску 1013,25 [гПа]:
Щільність води залежить від температури
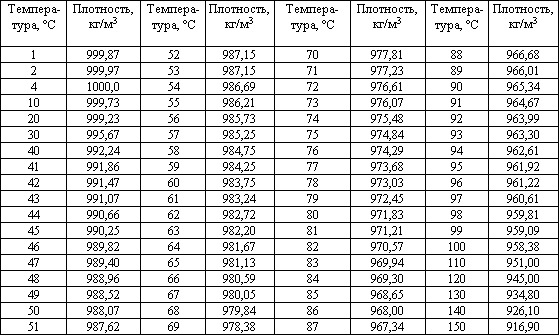
За звичайних умов вода при 4OC має найбільшу густину, яка становить 1000 кг/м 3 , тому прийнято, що 1 літр води важить 1 кг.
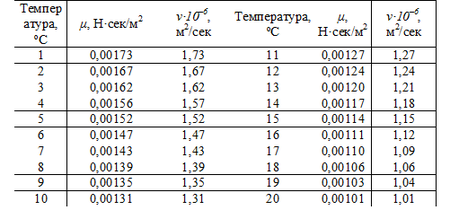
В’язкість води
В’язкість є ще однією важливою властивістю рідини після густини. Воно виникає лише під час відносного руху прилеглих один до одного шарів рідини і зникає після його припинення. В’язкість полягає в утворенні дотичних напруг, які можна розглядати як сили внутрішнього тертя, коли тонкі шари рідини рухаються один над одним з різними швидкостями. В’язкість – це опір текучості, отже, чим нижча в’язкість, тим рідина рідкіша та текучіша. Вимірювання в’язкості рідини проводять за допомогою віскозиметрів (віскозиметрів).
Коефіцієнт динамічної в’язкості
Динамічна в’язкість, також відома як коефіцієнт динамічної в’язкості, є мірою в’язкості рідини в потоці з градієнтом швидкості. Він позначається грецькою літерою μ (mi) і виражає відношення напруги зсуву до швидкості зсуву:

Де:
– τ – напруга зсуву [Па],
– γ – швидкість зсуву [1/с]
Динамічна в’язкість позначається грецькою літерою μ (мі), а її одиницею СІ є [Па с] або [кг /(м⋅с)].
Кінематичний (кінетичний) коефіцієнт в’язкості
Кінетична (кінематична) в’язкість, звана кінематичним коефіцієнтом в’язкості, є відношенням динамічної в’язкості до густини:
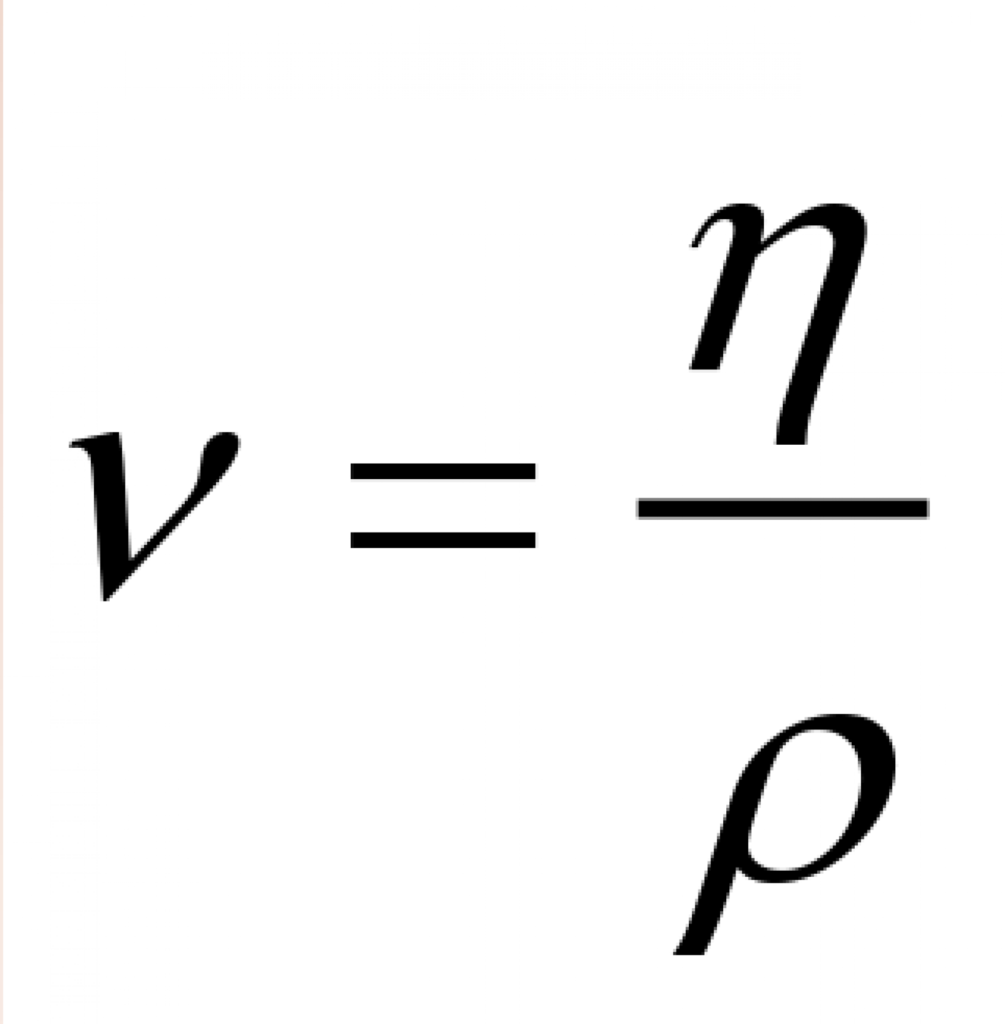
Де:
– μ – динамічна в’язкість [кг /(м⋅с)]
– ρ – щільність [кг/м 3 ]
Кінетична в’язкість позначається грецькою літерою ν (ni), а її одиницею в СІ є [м 2 /с].
В’язкість рідин, включаючи воду, залежить від структури їхніх молекул і ілюструє величину сил, які необхідно прикласти, щоб змусити потік. З підвищенням температури в рідинах відстань між частинками збільшується, що зменшує внутрішній опір течії, а отже, зменшується їх в’язкість.
В’язкість води залежить від температури
Нижче наведено таблицю, що показує динамічну в’язкість води для певних значень температури:
В’язкість води як функція температури
Властивості морської води – температура, солоність – географія
До фізичних властивостей води (особливо морської) належать: щільність, гідросферний тиск, прозорість води, температура води та її теплоємність, солоність води.
Щільність морської води становить близько 1,02474 г/см 3 і в кілька сотень разів перевищує щільність повітря. У результаті багато морських організмів, на відміну від птахів або літаючих комах, можуть вільно плавати у воді (планктон). У той же час така висока щільність середовища ускладнює пересування у воді, і більшість морських (і водних) плавців мають обтічні форми.
Температура вод океану в його поверхневих шарах становить в середньому 17,4 °С і коливається від -2 °С в полярних широтах до 30 °С біля екватора. Проте висока температура води в міжтропічних широтах поширюється лише на верхній 400-метровий шар вод океану, води якого інтенсивно перемішуються конвективними рухами. Під цим поверхневим теплим шаром знаходиться перехідна зона ( термоклін ), де температура води падає приблизно до 5°C. Таким чином, уся океанська глибина має температуру води трохи вище 0°C.
Вода має високу теплоємність. Тому він повільно нагрівається і повільно остигає. Це і велика площа поверхні океанів зумовлюють їх великий вплив на клімат Землі.
Сонячне світло проникає глибоко в океанську воду, але лише на певну глибину. У відкритому океані інтенсивність світла падає приблизно до 1% від поверхневого світла вже на глибині приблизно 50-80 м. Тільки в цьому верхньому шарі можуть розвиватися істоти, здатні до фотосинтезу.
Морська вода, в тому числі Від прісної вона відрізняється тим, що в ній розчинено набагато більше солі. Серед розчинених у воді солей найбільшу частку займає хлорид натрію – NaCl (бл. 78%). Це призводить до того, що морська вода має солоно-гіркий смак. Солоність моря – це загальна мінералізація морської води. Ми виражаємо їх у грамах твердих речовин, розчинених в 1 кілограмі води, тобто в проміле (‰)– тисячні частки цілого. Середня солоність морів і океанів становить близько 35‰, біля екватора вона трохи підвищується (39‰), а на полюсах, де тануть прісні води льодовиків і льодовикових покривів, знижується (34,5‰). Внутрішні моря найбільш солоні в умовах жаркого сухого клімату (наприклад, Червоне море – 45‰). Там дуже сильне випаровування води, що посилює концентрацію розчину. Води внутрішніх морів найменш солоні у вологому кліматі, де морські басейни роздуваються припливом річкових вод (солоність у Ботнічній затоці Балтійського моря становить лише близько 2‰).
Щільність морської води

Щільність морської води залежить від температури і солоності. Коли вода стає теплішою, її щільність зменшується, а тому її об’єм збільшується. Тиск – це вага стовпа води, тому, враховуючи його щільність, його легко обчислити, і ми не будемо аналізувати його далі. Температуру та солоність (і, отже, щільність) океанської води та океанських течій зараз дуже точно контролюють завдяки дослідженням, які занурюються глибоко в океан, вільно дрейфують на певній глибині протягом певного часу, а потім вимірюють вертикальні профілі цих параметрів у міру їх появи. Ми також спостерігаємо за допомогою супутників і наземних спостережень за рівнем моря в різних місцях земної кулі. Зараз через глобальне потепління ми спостерігаємо підвищення рівню океану із середньою швидкістю близько 3,4 мм на рік. Баланс маси льодовиків і вимірювання ARGO показують, що основною причиною цього збільшення (понад 60%) є танення наземних льодовиків. Однак приблизно 1/3 підвищення рівня моря відбувається за рахунок теплового розширення води. Частка, що залишилася, менше 10%, припадає на використання невідновлюваних (повільно відновлюваних) підземних вод, які потрапляють в океани з річками або дощем.
Оскільки процеси випаровування з поверхні океанів, стікання води з льодовиків, приплив і відтік теплової енергії розподіляються в просторі нерівномірно, а складні океанічні кругообіги і процеси змішування, що змінюються в часі і просторі, відбуваються повільно – вони не «встигає» за гомогенізацією температури і солоності морської води – цей розподіл температури і солоності, а отже, і щільності води в морях дуже неоднорідний. З цієї причини ми спостерігаємо значні відмінності в просторовому розподілі тенденції підвищення рівня моря.
Щільність води залежить від температури
Таблиця щільності води при температурах в діапазоні 0 – 100 градусів С при нормальному тиску.
Густина – це відношення маси обраної кількості речовини до об’єму, який вона займає. Вода – це рідина зі змінною густиною. Його концентрація або розрідження тісно пов’язані з температурою і тиском, але не залежать від сили тяжіння.
Максимальна щільність води досягається, коли вона досягає температури 4º Цельсія. Вище і нижче цього рівня щільність H₂O буде нижчою. Висота тиску також має велике значення – при нормальних умовах і значеннях 1013,25 гПа щільність води становить рівно 1000 кг на м³. Цей важливий факт дозволяє швидко розрахувати вагу цієї рідини – кожен її літр важить близько 1 кг. Щільність разом з в’язкістю води є одними з найважливіших характеристик цієї рідини.
Щільність води зазвичай позначають літерою d або грецьким символом ρ. Розраховується за формулою d = m/V, де d — щільність води, m — маса зразка, V — об’єм, який займає досліджувана рідина. Одиницею щільності в СІ є кілограм на кубічний метр (кг/м³). Його також можна назвати кілограмом на літр (кг/л) і грамом на кубічний сантиметр (г/см³). Приклад густини води при 25 градусах становить 997,07 кг/м3 , а при 20 градусах — 998,23 кг/м3.
Щільність води – табл
Нижче наводимо таблицю (таблицю), в якій представлені зміни щільності води в залежності від температури. Температуру виражають у градусах Цельсія, а щільність – у кілограмах на кубічний метр.
Таблиця щільності води
| температура | Щільність | температура | Щільність [кг/м 3 ] |
| -10 | 998,15 | 35 | 994,06 |
| -9 | 998,43 | 36 | 993,71 |
| -8 | 998,69 | 37 | 993,36 |
| -7 | 998,92 | 38 | 992,99 |
| -6 | 999,12 | 39 | 992,63 |
| -5 | 999,30 | 40 | 992,24 |
| -4 | 999,45 | 41 | 991,86 |
| -3 | 999,58 | 42 | 991,47 |
| -2 | 999,70 | 43 | 991,07 |
| -1 | 999,79 | 44 | 990,66 |
| 0 | 999,87 | 45 | 990,25 |
| 1 | 999,93 | 46 | 989,82 |
| 2 | 999,97 | 47 | 989,40 |
| 3 | 999,99 | 48 | 988,96 |
| 4 | 1000,00 | 49 | 988,52 |
| 5 | 999,99 | 50 | 988,07 |
| 6 | 999,97 | 51 | 987,61 |
| 7 | 999,93 | 52 | 987,15 |
| 8 | 999,88 | 53 | 986,69 |
| 9 | 999,81 | 54 | 986,21 |
| 10 | 999,73 | 55 | 985,73 |
| 11 | 999,63 | 60 | 983,24 |
| 12 | 999,52 | 65 | 980,59 |
| 13 | 999,40 | 70 | 977,81 |
| 14 | 999,27 | 75 | 974,89 |
| 15 | 999,13 | 80 | 971,83 |
| 16 | 998,97 | 85 | 968,65 |
| 17 | 998,80 | 90 | 965,34 |
| 18 | 998,62 | 95 | 961,92 |
| 19 | 998,43 | 100 | 958,38 |
| 20 | 998,23 | 110 | 951,00 |
| 21 | 998,02 | 120 | 943,40 |
| 22 | 997,80 | 130 | 935,20 |
| 23 | 997,56 | 140 | 926,40 |
| 24 | 997,32 | 150 | 917,30 |
| 25 | 997,07 | 160 | 907,50 |
| 26 | 996,81 | 170 | 897,30 |
| 27 | 996,54 | 180 | 886,60 |
| 28 | 996,26 | 190 | 875,00 |
| 29 | 995,97 | 200 | 862,80 |
| 30 | 995,67 | 210 | 850,00 |
| 31 | 995,37 | 220 | 837,00 |
| 32 | 995,05 | 230 | 823,00 |
| 33 | 994,73 | 240 | 809,00 |
| 34 | 994,40 | 250 | 794,00 |
Щільність води залежить від температури. Таблиця.
У таблиці наведено значення щільності води в г/мл для різних температур в інтервалі від 0 до 100 °С.
| температура, °С | щільність, г/мл | температура, °С | щільність, г/мл |
| 0 | 0.99987 | 52 | 0.9872 |
| 2 | 0.99997 | 54 | 0.9862 |
| 4 | 1.00000 | 56 | 0.9853 |
| 6 | 0.99997 | 58 | 0.9843 |
| 8 | 0.99988 | 60 | 0.9832 |
| 10 | 0.99973 | 62 | 0.9822 |
| 12 | 0.99953 | 64 | 0.9811 |
| 14 | 0.99927 | 66 | 0.9801 |
| 16 | 0.99897 | 68 | 0.9789 |
| 18 | 0.99862 | 70 | 0.9778 |
| 20 | 0.99823 | 72 | 0.9767 |
| 22 | 0.99780 | 74 | 0.9755 |
| 24 | 0.99733 | 76 | 0.9743 |
| 26 | 0.99681 | 78 | 0.9731 |
| 28 | 0.99626 | 80 | 0.9718 |
| 30 | 0.99568 | 82 | 0.9706 |
| 32 | 0.99506 | 84 | 0.9693 |
| 34 | 0.99440 | 86 | 0.9680 |
| 36 | 0.99372 | 88 | 0.9667 |
| 38 | 0.99300 | 90 | 0.9653 |
| 40 | 0,99225 | 92 | 0.9640 |
| 42 | 0,99147 | 94 | 0.9626 |
| 44 | 0.9907 | 96 | 0.9612 |
| 46 | 0.9898 | 98 | 0.9598 |
| 48 | 0.9890 | 100 | 0.9584 |
| 50 | 0.9881 |
Щільність дистильованої води з різних джерел при 4 с
| Джерело | Щільність, г/мл | Джерело | Щільність, г/мл |
| Сніг | 0,9999977 | Тварини | 1,0000012 |
| Дощ | 0,9999990 | Рослини | 1,0000017 |
| Річки | 1 | Кристалізаційна вода мінералів | 1,0000024 |
| Океан | 1,0000015 |
У той же час очевидно, що склад молекул води Н 2 Про не залежить від способу отримання (ставлення числа атомів Н до атомів Про завжди 2 : 1).
Отже, закон сталості складу суворо виконується лише молекул !
приклад 2.3. Обчисліть значення масових часток елементів у сірчистій кислоті.
Рішення. Масова частка елемента в речовині може бути обчислена за такою формулою:
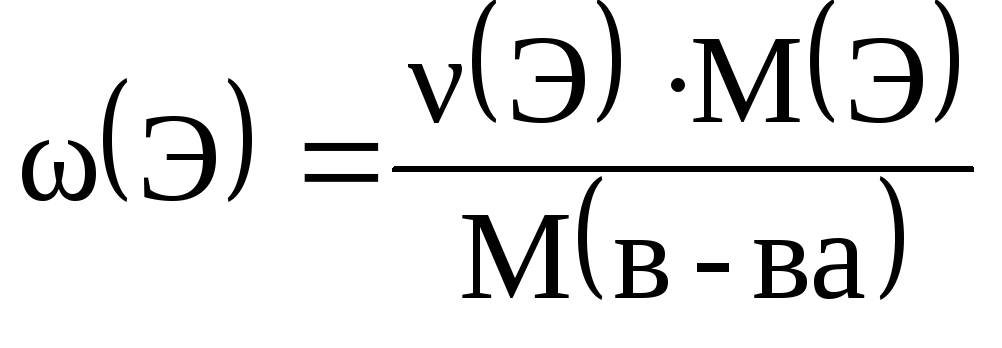
,
де (Е) – кількість даного елемента в 1 моль речовини.
Молярна маса сірчаної кислоти:
M(H 2 SO 4 ) = 2М(H) + М(S) + 4М(O) = 2 + 32 + 64 = 98 (г/моль).
Масові частки елементів у сірчаній кислоті:
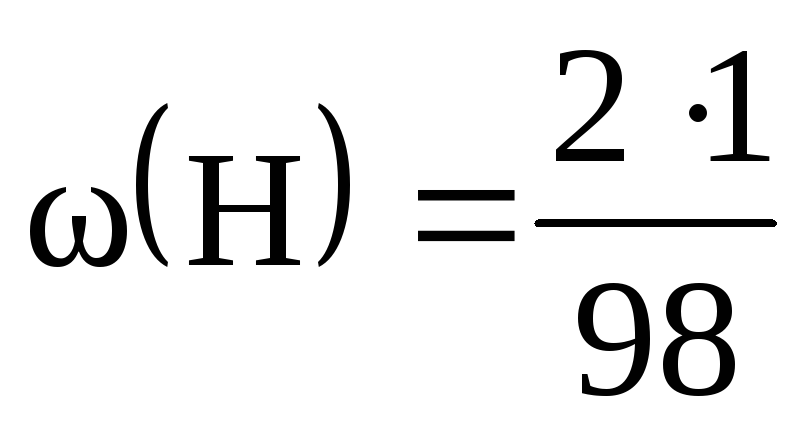
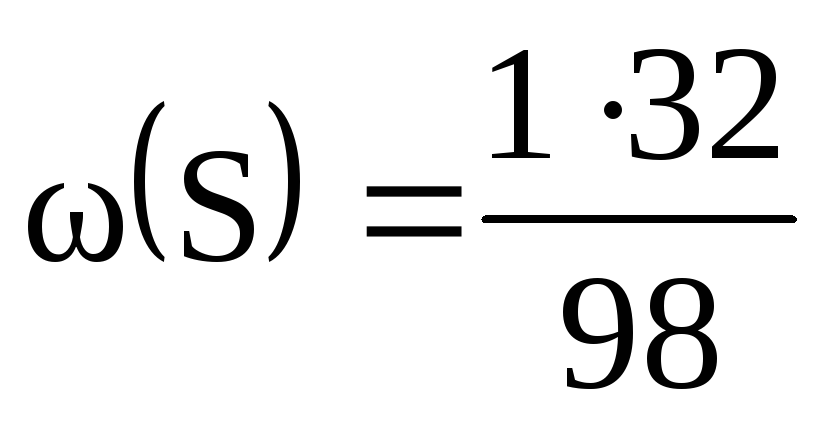
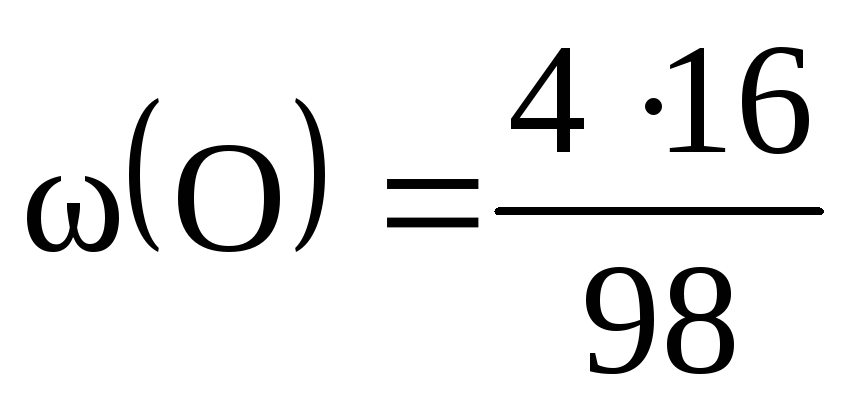
= 0,02, або 2%; = 0,33, чи 33%; = 0,65, чи 65%.
Приклад 2.4. Визначте найпростішу формулу одного з оксидів сірки, якщо масова частка кисню у ньому дорівнює 50%.
Рішення. Масова частка сірки в оксиді:
(S) = 100 – 50 = 50%.
Знайдемо відношення кількостей сірки та кисню 1 :
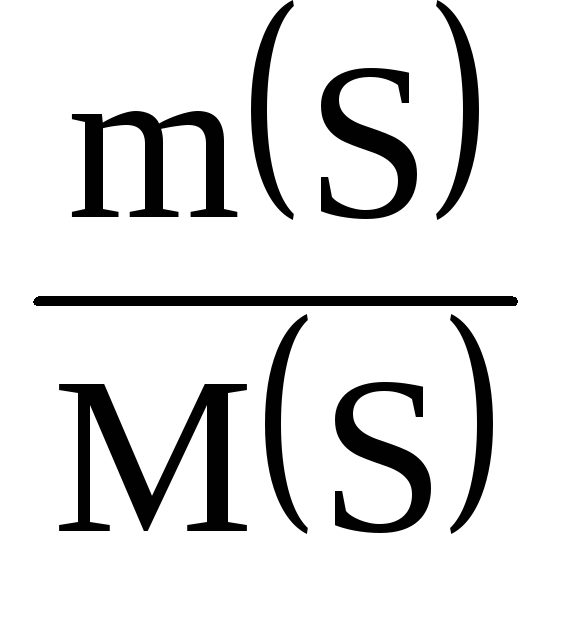
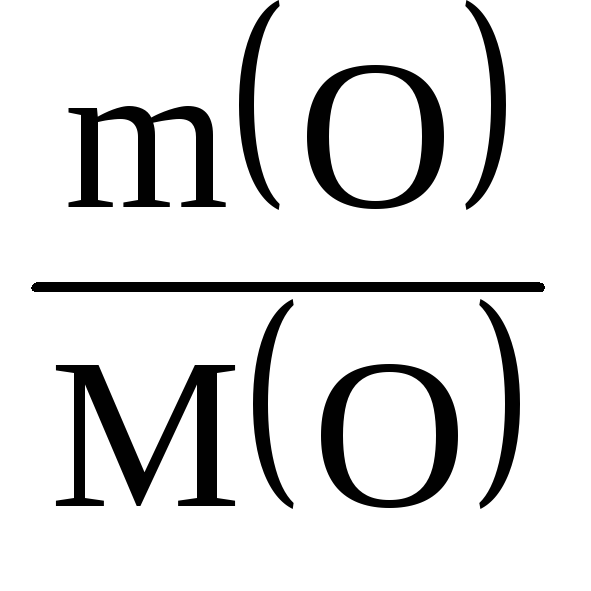
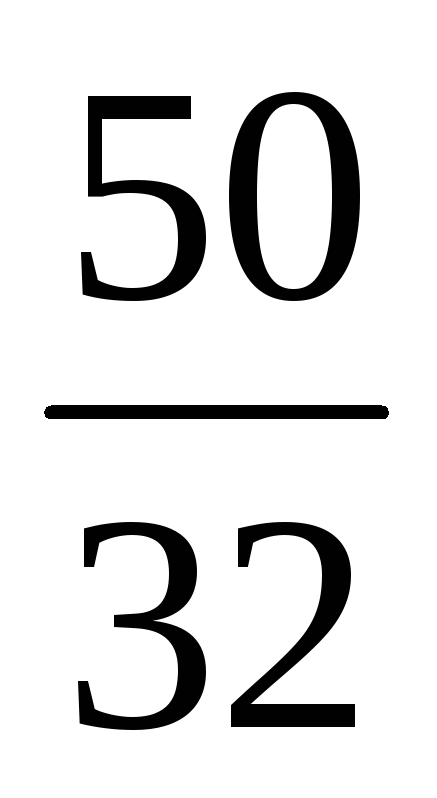
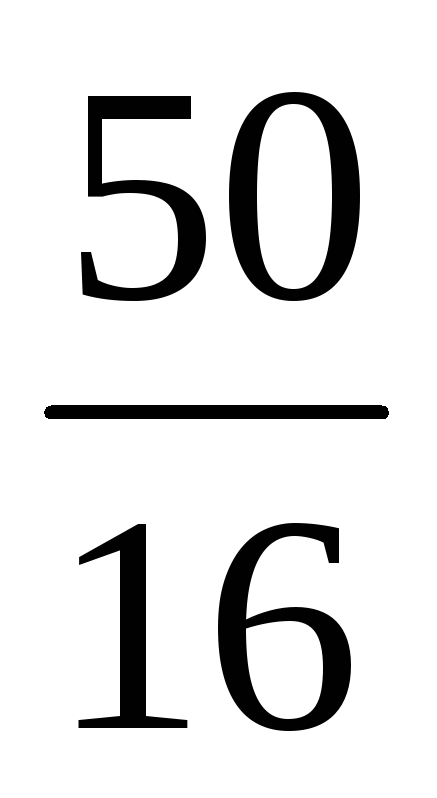
(S) : (O) = : = : = 1,56 : 3,13 = 1 : 2.
Отже, найпростіша формула оксиду – SO2 .
2.3. Закон об’ємних відносин. Закон Авогадро
Закон об’ємних відносин газів було відкрито Ж. Л. Гей-Люссаком. Вже 1805 р. Гей-Люссак і А. фон Гумбольдт, вивчаючи відносини обсягів реагуючих газів, встановили, що обсяг кисню з’єднується з двома обсягами водню. Ця робота була тісно пов’язана з подальшими дослідженнями газових реакцій Гей-Люссаком. Результати своїх робіт він опублікував у 1808 р. у статті “Про з’єднання газоподібних тіл один з одним”. Він хотів «довести, що газоподібні тіла з’єднуються один з одним у дуже простих відносинах і що зменшення обсягу, яке спостерігається під час реакцій, підпорядковується певному закону».
Сформульоване Гей-Люссаком узагальнення відоме під назвою закону простих об’ємних відносинабо «хімічного» закону Гей-Люссака:
Обсяги вступають у реакцію газів за однакових умов (температурі та тиску) відносяться один до одного і до обсягів газоподібних продуктів реакції як прості цілі числа.
Наприклад, у реакції
H 2 + Cl 2 = 2HCl V(H 2 ) : V(Cl 2 ) : V(HCl) = 1 : 1 : 2.
У 1810 р. у другій частині своєї роботи “Нова система хімічної філософії” Дальтон рішуче виступив проти відкритого Гей-Люссаком закону, побачивши в ньому не підтвердження, а загрозу атомістичній гіпотезі. Дальтон багато міркував на цю тему. Спочатку він навіть припускав, що в одному обсязі кисню міститься стільки ж атомів, скільки і в одному об’ємі водню. «Однак пізніше я став дотримуватись іншої думки, і до цього привів мене такий аргумент: один атом оксиду азоту складається з одного атома азоту та одного атома кисню. Тепер, якщо в однакових обсягах міститься однакове число атомів, то при взаємодії одного об’єму азоту з одним об’ємом кисню повинен утворитися один об’єм оксиду азоту, але, згідно з даними Генрі, утворюються приблизно два обсяги; тому оксид азоту у тому обсязі може містити лише половину атомів (проти азотом і киснем)».
Деякі інші дані, здавалося, також суперечили атомістичній гіпотезі. Наприклад, згідно з уявленнями Дальтона, щільність монооксиду вуглецю як речовини, що складається з двох атомів, повинна бути більшою за щільність кисню як речовини, що складається з одного атома, проте насправді вона менша. Так само щільність парів води виявилася меншою за щільність кисню.
Ні Дальтону, ні Гей-Люссаку не вдалося пояснити протиріччя між атомістичною гіпотезою та газовими законами.
Ці протиріччя було усунуто 1811 р. А. Авогадро. У роботі «Нарис методу визначення відносних мас елементарних молекул тіл і пропорцій, згідно з якими вони входять до сполук», він пояснив прості відносини між обсягами газів, що спостерігаються при хімічних реакціях, сформулювавши закон, названий згодом його ім’ям:
У рівних обсягах різних газів за однакових умов (температури та тиску) міститься рівне число молекул.
Із закону Авогадро випливають важливі наслідки:
1. За однакових умов 1 моль будь-якого газу займає однаковий об’єм. Так, за нормальних умов (Т = 273,15 К, p = 101325 Па):
V m (газу) = 22,4 л/моль (н. у.).
2. Молярна маса речовини в газоподібному стані дорівнює його подвоєної щільності водню.
Відносна щільність газу – це число, що показує, у скільки разів один газ важчий за інший.
Наприклад, відносна щільність газу Х газу Y:
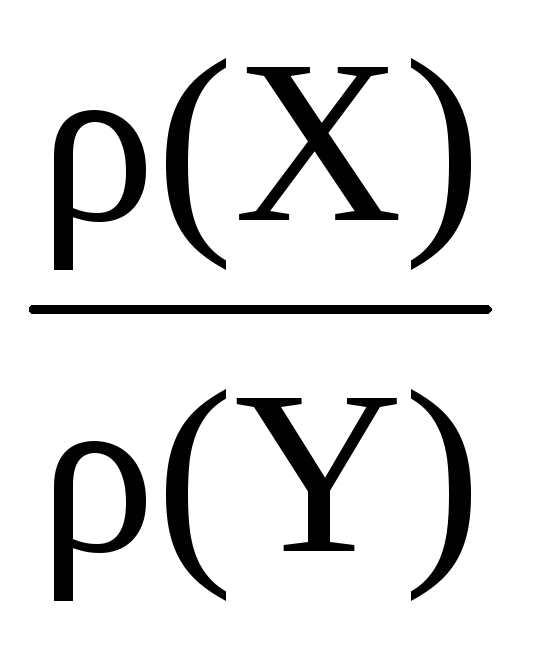
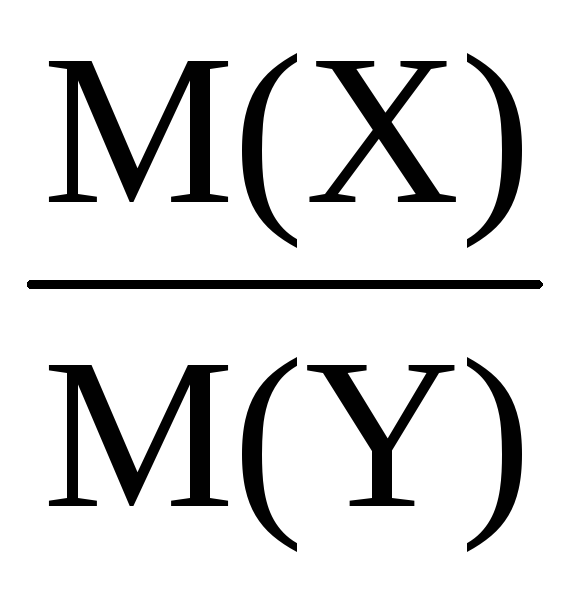
DY ( Х) = = .
Найчастіше щільність газів визначають по відношенню до водню або повітря (подумайте, чому):
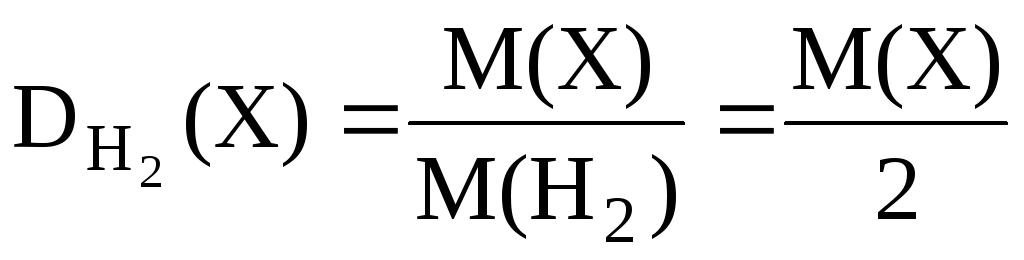
-Відносна щільність газу Х по водню;
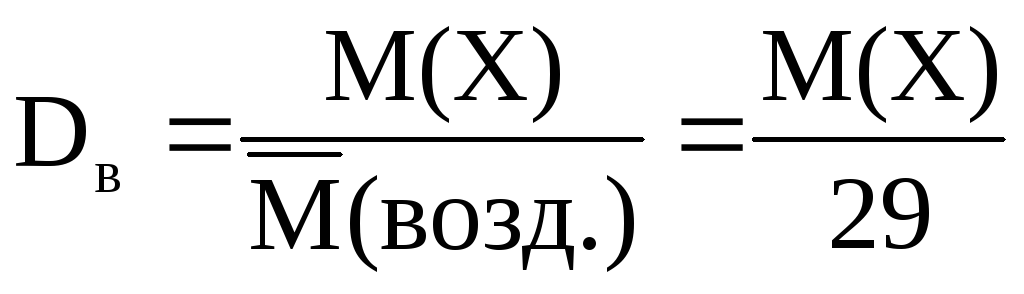
-відносна щільність газу Х повітрям,

де – середня молярна маса.
За відносними щільностями можна розраховувати молярні маси речовин. Так:
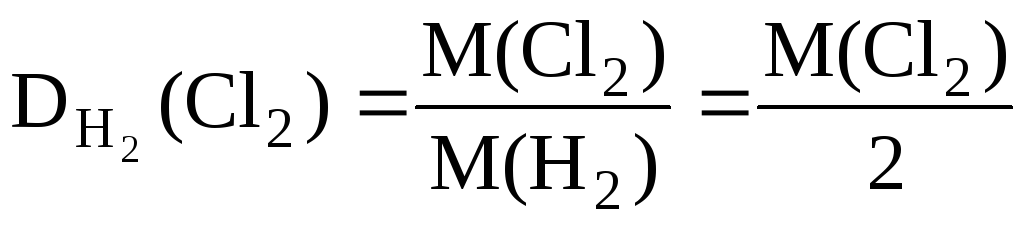
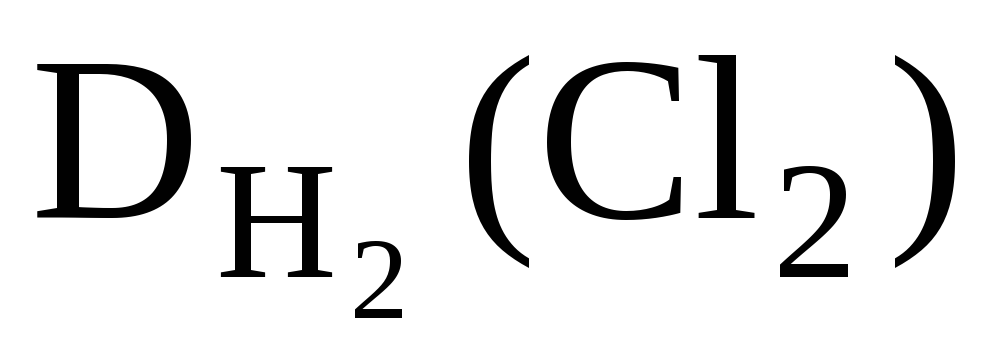
, Отже, M(Cl 2 ) = 2· .
приклад 2.5. Який обсяг кисню потрібний для спалювання 4 м 3 етану? Який обсяг вуглекислого газу утворюється при цьому?
Рішення: запишемо рівняння реакції горіння етану:
2С 2 Н 6 + 7О 2 = 4СО 2 + 6Н 2 О
Гази, що беруть участь у реакції, знаходяться за однакових умов, тому для розрахунку їх обсягів не обов’язково знаходити кількість речовин, а можна застосувати закон Гей-Люссака та перше слідство із закону Авогадро.
По рівнянню реакції:
для спалювання 2 обсягів З 2 Н 6 необхідно 7 обсягів О 2
а спалювання 4 м 3 З 2 Н 6 – V м 3 Про 2 .
V(O 2 ) = 4 ∙ 7 / 2 = 14 (м 3 ).
Аналогічно розраховуємо обсяг вуглекислого газу, що отримується в реакції:
при спалюванні 2 обсягів 2 Н 6 утворюється 4 обсяги 2 ,
а при спалюванні 4 м 3 З 2 Н 6 – V м 3 СО 2 .
V(СО 2 ) = 4 ∙ 4 / 2 = 8 (м 3 ).
приклад 2.6. Щільність оксиду азоту воднем дорівнює 23. Чому дорівнює щільність цього газу повітрям?
Рішення. Знаючи щільність оксиду азоту воднем, можна розрахувати його молярну масу:
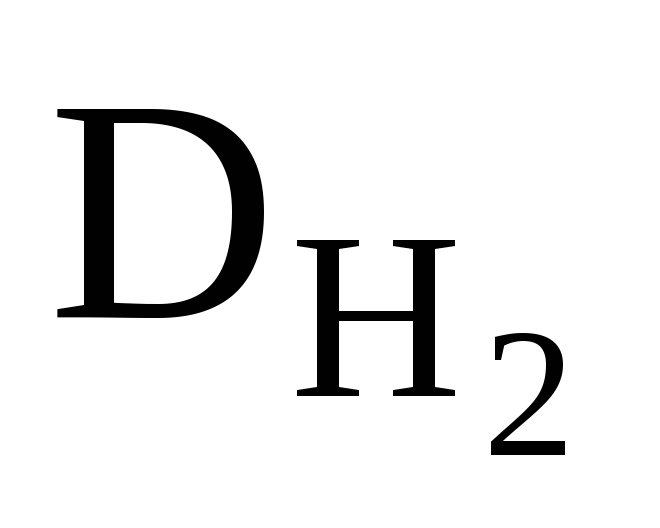
М(N x O y ) = (N x O y ) ∙ М(H 2 ); М(N x O y ) = 23 ∙ 2 = 46 (г/моль ) .
Щільність цього газу повітрям дорівнює:
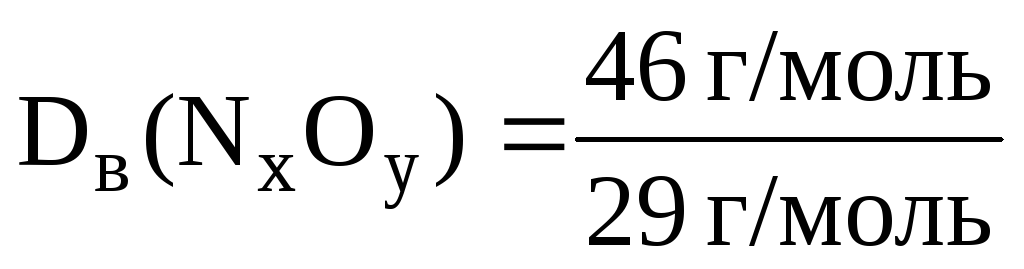
= 1,6.
приклад 2.7. Знайдіть середню молярну масу та щільність (при н. у.) повітря, що має об’ємний склад: 20,0% О 2 ; 79,0% N 2 , 1% Ar.
Рішення. Оскільки обсяги газів пропорційні до їх кількості (закон Авогадро), то середню молярну масу суміші газів можна виражати не тільки через кількості, а й через обсяги:
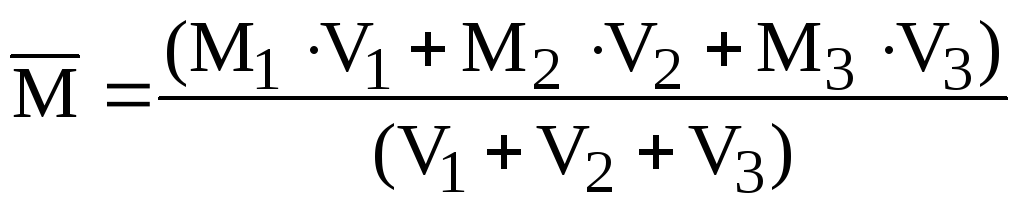
.
Візьмемо 100 л суміші та обчислимо об’єм кожного компонента за формулою:
V(газу) = (газу) ∙ V(суміші),
де – об’ємна частка, виражена у частках одиниці.
V(O 2 ) = 0,20 ∙ 100 = 20 (л); V(N 2 ) = 0,79 ∙ 100 = 79 (л); V(Ar) = 0,01 ∙ 100 = 1 (л).
Підставляючи ці значення формулу, отримаємо:
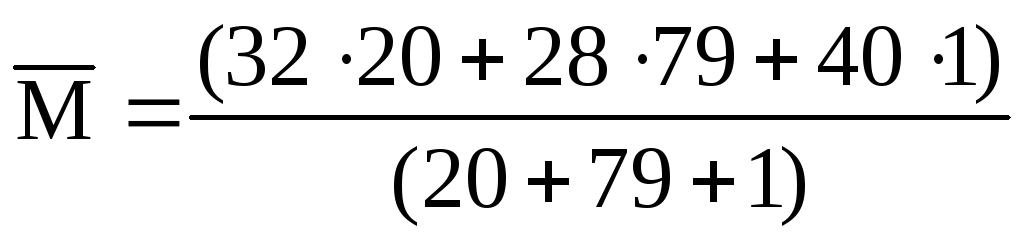
= 28,9 (г/моль).
Щільність за нормальних умов дорівнює молярній масі, поділеній на молярний об’єм:
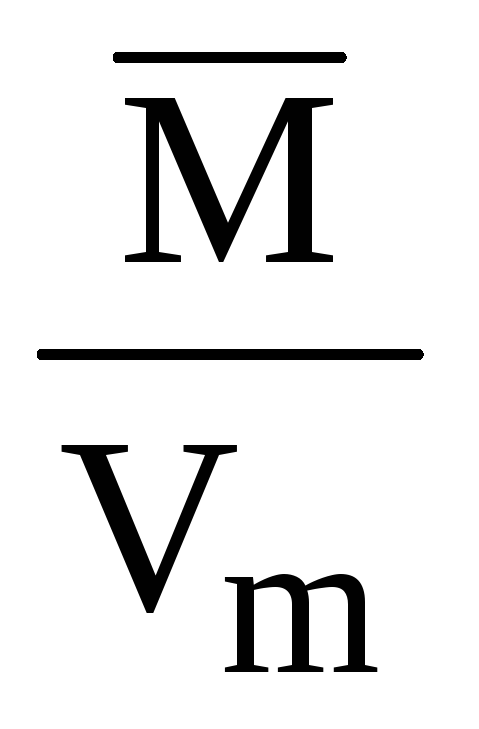
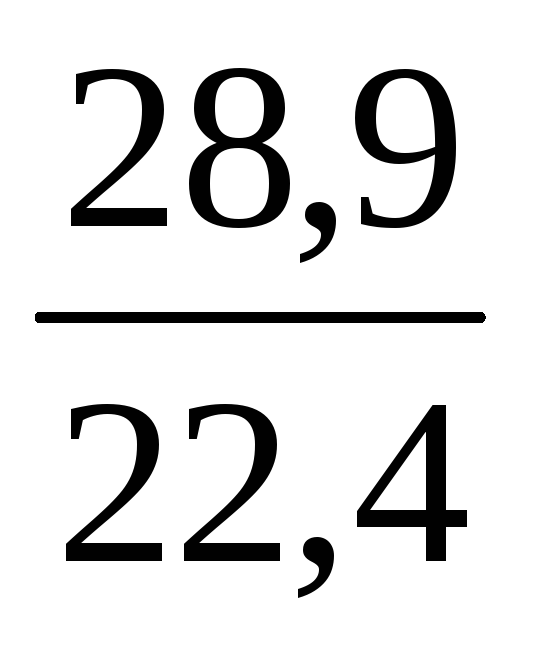
= ; (повітря) = = 1,29 (г/л) = 1,29∙10 –3 (г/см 3 ).
приклад 2.8. Щільність суміші кисню та озону по водню дорівнює 17. Визначте масову та об’ємну частку кисню у суміші.
Рішення. Середня молярна маса цієї суміші газів:
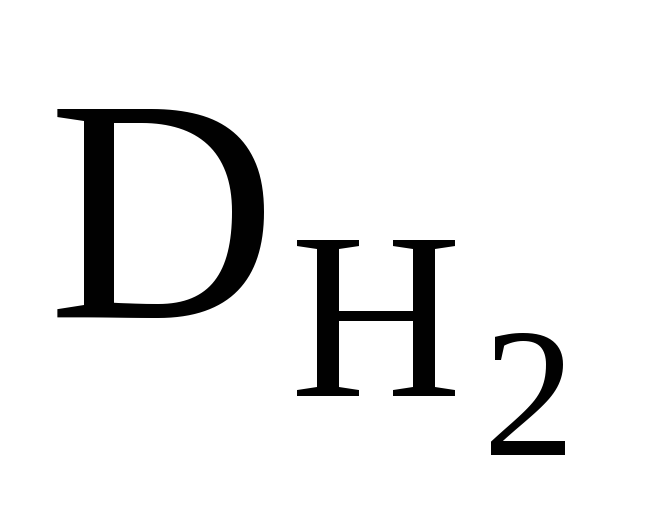
М? (суміші) = ∙ М (Н 2 ); М? (суміші) = 17 ∙ 2 = 34 (г/моль).
Нехай у суміші міститься х моль О 2 і моль О 3 . Співвідношення між х і у можна знайти через середню молярну масу:
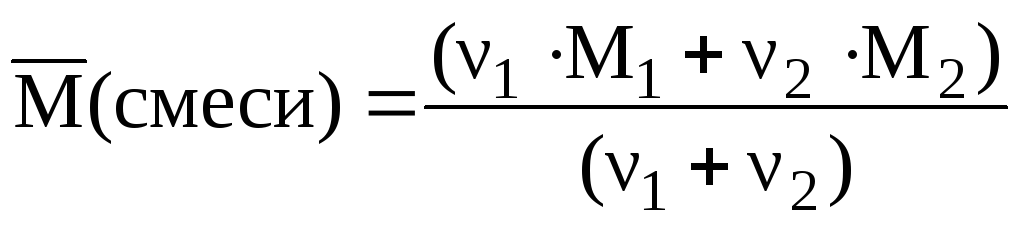
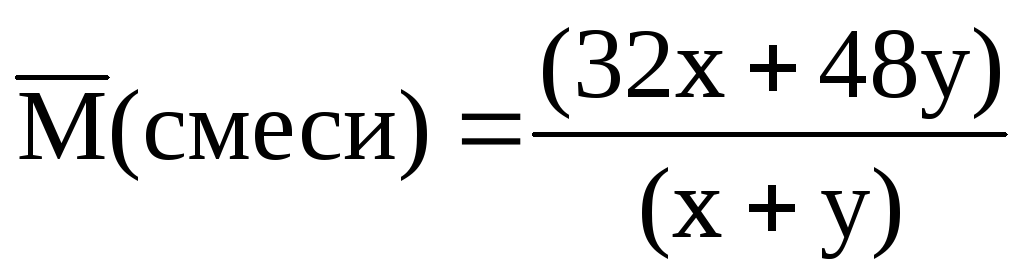
; = 34 (г/моль).
З отриманого виразу знаходимо х = 7у.
Таким чином, співвідношення кількостей кисню та озону в суміші:
(О 2 ) = 7 ∙ (О 3 ).
За законом Авогадро обсяги газів прямо пропорційні їх кількості, тому об’ємна частка газу в суміші завжди дорівнює його мольній частці:
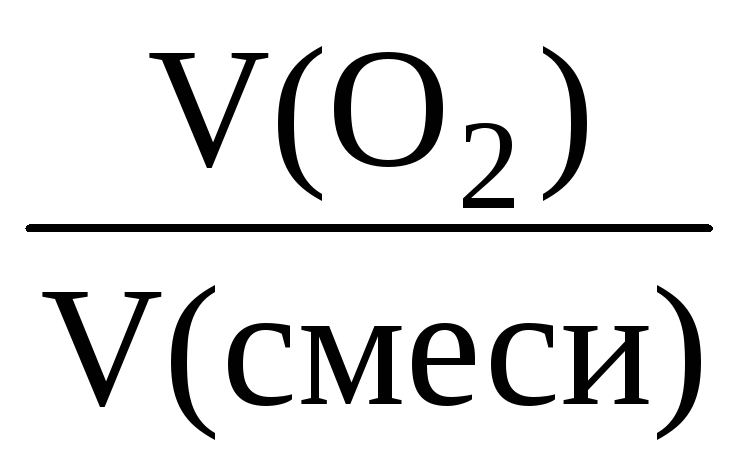
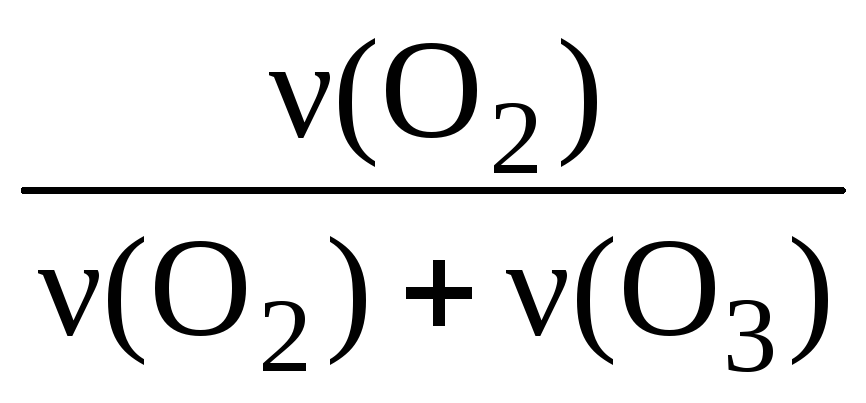
(Про 2 ) = = ;
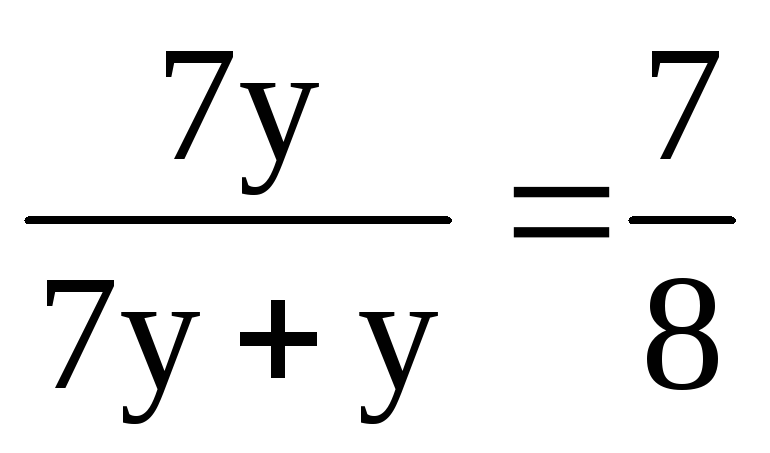
(О 2 ) = = 0,875 (або 87,5%).
Знайдемо масову частку кисню у суміші:
m(O 2 ) = (О 2 ) ∙ M(O 2 ); m(O 2 ) = 32х = 32 ∙ 7у = 224у;
m(O 3 ) = (О 3 ) ∙ M(O 3 ); m(O 3 ) = 48у.
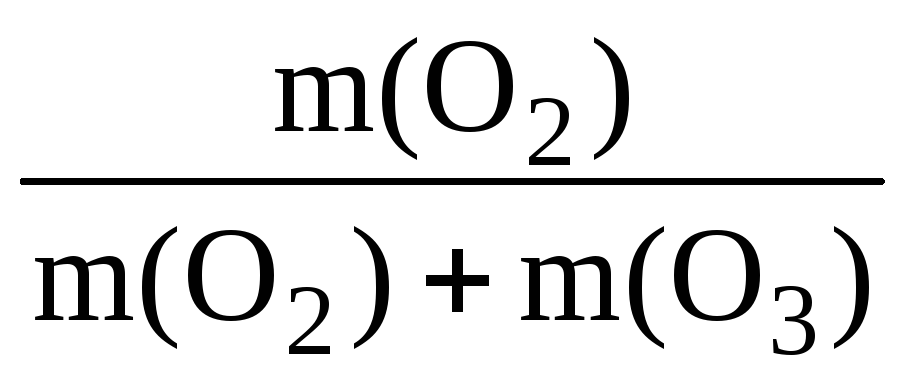
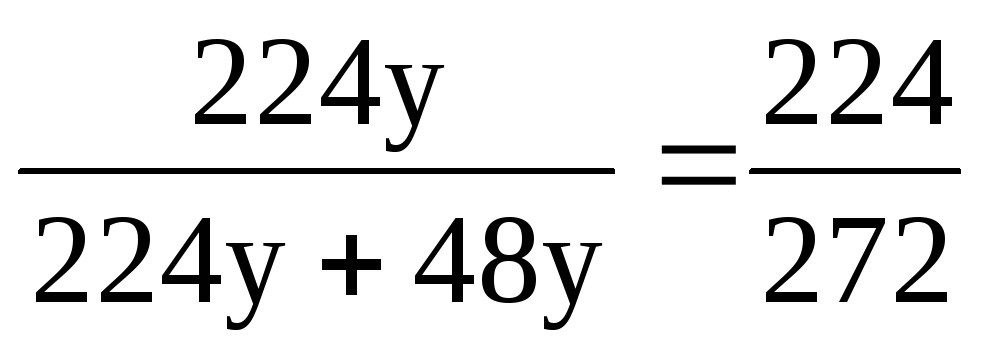
(О 2 ) = ;(О 2 ) = = 0,824 (або 82,4%).

